Cân nhắc lợi ích và nguy cơ khi dùng thuốc ức chế yếu tố TNF-α để điều trị các bệnh gây viêm mãn tính 30/11/2015 08:45
Giới thiệu
Các bệnh viêm mãn đã ảnh hưởng đến xương - khớp, ruột và da mà hàng triệu người mắc đang tăng lên và trở thành vấn đề của y tế công cộng. TNF-a là yếu tố trung gian gây viêm quan trọng của các bệnh này và là một đích quan trọng của các can thiệp điều trị. Dùng các chất đối kháng TNF-a có tác dụng ngăn cản sự tương tác giữa TNF-a và các đầu tiếp nhận (receptor) của nó nằm ở bề mặt tế bào đích và có hiệu lực điều trị trong nhiều bệnh viêm mãn tính, với khả năng giảm bớt gánh nặng về thể chất, tâm lý, xã hội và tài chính có ý nghĩa đáng kể. Hiện có chất ức chế TNF được phép sử dụng để điều trị các bệnh viêm mãn ở một số nơi trên thế giới.
Mặc dầu, sự phát hiện các chất ức chế TNF để điều trị các bệnh viêm mãn tính có lẽ là bước đột phá quan trọng nhất trong thập kỷ qua, nhưng do tính an toàn liên quan đến việc thuốc có thể tạo điều kiện cho các nhiễm khuẩn nặng và nhiễm trùng cơ hội phát triển (nhiễm trùng nặng được xác định là khi mắc người bệnh cần phải nhập viện hoặc điều trị kháng sinh đường tiêm truyền), mà người thầy thuốc cần cảnh giác cao độ. Dùng các chất ức chế TNF sẽ thể hiện những phiền toái đáng kể không chỉ đối với các chuyên gia kê đơn cho bệnh nhân mà còn đối với các thầy thuốc lâm sàng chăm sóc sức khoẻ ban đầu khi dùng các thuốc ức chế TNF.
Các bệnh viêm mãn tính và nguy cơ về nhiễm trùng nặng
Bệnh nhân mắc các bệnh viêm mãn tính có nguy cơ mắc các bệnh nhiễm trùng nặng và tử vong khi được điều trị với các thuốc ức chế miễn dịch, hoặc do bệnh nguyên nhân và do cách điều trị truyền thống (ví dụ, prednisone). Một trong những bệnh viêm mãn tính được nghiên cứu nhiều nhất là viêm khớp dạng thấp (RA), một bệnh ảnh hưởng đến 0,5% - 1,0% dân chúng Mỹ. Người mắc viêm khớp dạng thấp chết do viêm phổi cao gấp 5 lần so với người bình thường trong cộng đồng, và tỷ lệ nhiễm trùng nặng vào lúc nghiên cứu cao chừng 9/100 bệnh nhân/năm (ít nhất 9 của mỗi 100 bệnh nhân được điều trị trong 1 năm phát triển 1 bệnh nhiễm trùng cần phải nhập viện), tỷ lệ gần như gấp 2 trong quần thể tổng quát. Các nguy cơ tương đối đối với nhiễm khuẩn da, phổi và xương hoặc khớp liên quan chặt chẽ RA đơn thuần, mà độc lập với việc dùng prednisone và các yếu tố nguy cơ nhiễm khuẩn khác.
Những biến đổi miễn dịch chính xác gây bất thường sức bảo vệ vật chủ chống bệnh nhiễm khuẩn trong RA chưa được hiểu rõ hoàn toàn. Qua thời gian các thay đổi của quá trình tế bào lymphô T, làm thích hợp cho một lượng thừa tương đối của các tế bào diệt T CD-28 (lymphocyte T CD-28 null). Các tế bào này bị giảm năng lực kích thích các tế bào B và giảm điều hoà các tế bào đuôi gai trình diện kháng nguyên. Hơn nữa, việc phát sinh các tế bào lymphô T ở bệnh nhân mắc RA bị giảm, từ đó mà rút ngắn tiến trình tiến hoá của các quần thể T lymphocyte và sự già yếu miễn dịch, tương tự với sự rút ngắn được nhìn thấy trong vật chủ lớn tuổi bình thường.
Prednisone và các cách điều trị không nhắm vào đích tác dụng được dùng trước hoặc cùng lúc kết hợp với các thuốc ức chế TNF để điều trị các bệnh viêm mãn tính cũng có thể làm tăng nguy cơ nhiễm khuẩn. Prednisone, thậm chí dùng liều thấp (< 15 mg/ngày) sẽ làm tăng nguy cơ nhiễm khuẩn nghiêm trọng gấp 2 lần ở quần thể bệnh nhân RA, và nguy cơ tăng lên với những liều thuốc cao hơn. Đặc biệt đối với bệnh lao, nguy cơ này cũng tăng lên trong quần thể tổng quát với bệnh nhân dùng bất cứ loại liều thuốc nào của corticosteroids.
Một mô hình hữu ích: Bệnh sinh của viêm khớp dạng thấp
Sự hiểu biết về bệnh sinh viêm khớp dạng thấp cần cho sự hiểu rõ về đích tác dụng của các thuốc ức chế TNF. Trên mô hình do Scott và Kingsley mô tả, một tác nhân gây nhiễm hoặc kích thích khác gắn với các đầu tiếp nhận ở các tế bào đuôi gai, để hoạt hoá hệ thống miễn dịch nguyên thuỷ (Hình 1). Các tế bào đuôi gai di chuyển đến - tồn tại ở hạch bạch huyết và trình diện kháng nguyên với các tế bào T, các tế bào T được hoạt hoá của tín hiệu đôi của sự trình diện kháng nguyên và các sự đồng kích thích của T CD-28. Các tế bào T được hoạt hoá tăng sinh và di chuyển đến và khu trú ở khớp. Ở mô khớp, tế bào T sản xuất IFN – gamma và các cytokines tiền viêm khác mà kích thích đại thực bào và các nguyên bào sợi (fibroblasts) cũng như các tế bào sụn (chondrocytes), tế bào huỷ xương (osteoclasts), và tế bào B. Các đại thực bào và nguyên bào sợi bị hoạt hoá giải phóng ra các cytokines khác nhau, gồm TNF-alpha, một thành phần trung tâm của dây chuyền cytokine mà kích thích sự sản xuất các chất trung gian phụ gây viêm khác và sự tuyển mộ các tế bào miễn dịch và tế bào viêm đi vào khớp.
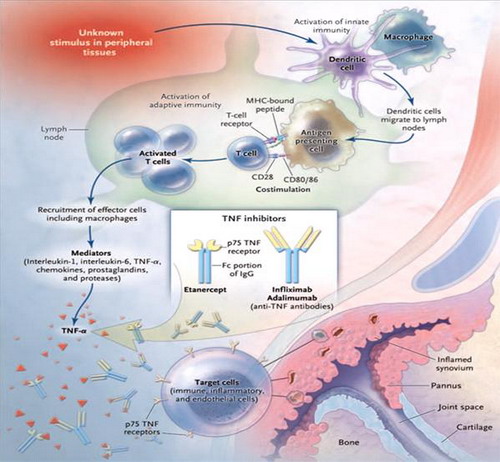
Hình 1. Vai trò sinh lý bệnh của cytokines và các chất trung gian khác và các chất ức chế cytokines trong viêm khớp dạng thấp. Nguồn: Scott DL, Kingsley GH. Tumor necrosis factor inhibitors for rheumatoid arthritis. N Engl J Med. 2006;355:704-712.
Các chất ức chế TNF: Một con dao hai lưỡi ?
Với tính chất là một lớp, các chất ức chế TNF ngăn cản TNF-alpha, đây là một cytokine tiền viêm quan trọng trong bệnh sinh của nhiều bệnh trung gan miễn dịch. TNF-alpha trung gian cho các đáp ứng viêm toàn thân qua con đường 2 đầu tiếp nhận (p55 và p75), và tác dụng của nó thì rất nhiều. Mặc dầu, quan trọng với sự trung gian của các tiến trình bệnh này, TNF-alpha cũng là cơ bản với chức năng miễn dịch bẩm sinh và trung gian đáp ứng vật chủ chống lại một loạt các tác nhân gây nhiễm trùng cơ hội, gồm mycobacteria, nấm, ký sinh trùng, và các vi khuẩn nội bào khác.
TNF kích thích sự hình thành và bảo tồn u hạt - một tổ chức được hình thành với sự tụ tập các đại thực bào và các lymphocyte trong quá trình đáp ứng với kích thích tồn tại - tổ chức đó nhấn chìm các tác nhân gây bệnh nào đó vào bên trong (Hình 2). Các u hạt là đặc điểm của bệnh lao. Đáp ứng dạng u hạt là cơ bản đối với bệnh lao, các nhiễm nấm, và nhiễm các tác nhân gây bệnh sống nội bào khác; và sự tương tác giữa TNF và đầu tiếp nhận p55 phát tín hiệu của nó hình như là quan trọng đối với trung gian của tiến trình này. Điều này đã được thiết lập trong các nghiên cứu trên mô hình chuột, trong đó chuột thiếu hoặc là TNF hoặc là đầu tiếp nhận p55 phát tính hiệu của nó thì sẽ không thể thu hút các tế bào viêm đến vị trí bị nhiễm mycobacterium và cũng không thể hình thành được các u hạt có tính chức năng. Sự trung hoà TNF trong chuột được gây nhiễm vi khuẩn lao dẫn đến sự la toả vi khuẩn lao nhanh chóng toàn cơ thể và tử vong do tiêu các u hạt đã được hình thành trước rồi. Chuột thiếu đi sự phát tín hiệu nguyên vẹn theo con đường p55/TNF sẽ nhạy cảm hơn với nhiễm Leishmania, Listeria, Histoplasma, các tác nhân nấm và ký sinh trùng gây bệnh khác, và thậm chí cả các vi khuẩn không hình thành được u hạt ngay như phế cầu và Klebsiella pneumoniae. Cuối cùng, TNF hoạt hoá trực tiếp đại thực bào để thực bào và kết hợp với cytokine là IFN-gamma, tiêu diệt vi khuẩn lao và một loạt các tác nhân gây bệnh khác.
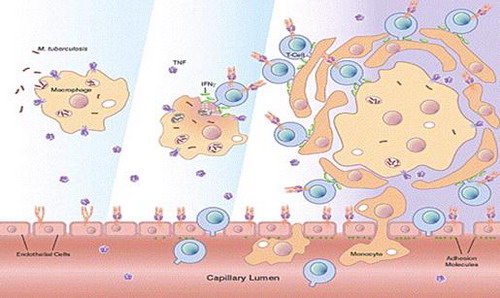
Hình 2. Sự hình thành u hạt trong nhiễm M tuberculosis. Phía trái: Các thành phần của mycobacterium tương tác với các đầu tiếp nhận toll-like ở bề mặt đại thực bào, khởi động sự sản xuất TNF. Phần giữa: TNF được tiết ra gắn với các đầu tiếp nhận TNF ở bề mặt các tế bào nội mạc, gồm sự biểu thị của các phân tử kêt dính và các chemokines, dẫn đến các tế bào T và tế bào đơn nhân rời tuần hoàn máu và di chuyển đến vị trí nhiễm trùng. Các tế bào T nhận diện các tế bào bị nhiễm và bị TNF kích thích, dẫn đến giải phóng IFN-gamma và gây cảm ứng bộ máy diệt khuẩn nội bào của đại thực bào. Phía phải: Các đại thực bào bị nhiễm có thể hoà màng để hình thành các tế bào phì đại (giant cells). Một u hạt trưởng thành được hình thành với các đại thực bào dạng biểu mô và các tế bào T, làm tách biệt khu vực nhiễm khuẩn trong cơ thể vật chủ. Sự tiết TNF được tiếp tục được cần đến để bảo tồn cấu trúc u hạt.
Nguồn: Furst DE, Wallis R, Broder M, Beenhower DO. Tumor necrosis factor antagonists: different kinetics and/or mechanisms of action may explain differences in the risk for developing granulomatous infection. Seminars in Arthritis and Rheumatism. 2006;36(3):159-167.
Đích điều trị của các chất ức chế TNF
Có 5 chất ức chế TNF (infliximab, etanercept, adalimumab, certolizumab, và golimumab) được Cơ quan Quản lý Dược và Thực phẩm Hoa Kỳ thừa nhận dùng trong điều trị cho nhiều bệnh gây viêm mãn khác nhau (xem Bảng 1).
Bảng 1. Các chất ức chế TNF được thừa nhận trong điều trị các bệnh gây viêm mãn tính ở Hoa Kỳ
|
Thuốc |
Mô tả |
Các chỉ định |
Cách dùng |
|
Adalimumab |
Kháng thể anti-TNF-ađơn dòng của người |
Viêm khớp dạng thấp Bệnh Crohn Viêm cột sống dính khớp |
Tiêm dưới da 2 tuần/lần |
|
Certolizumab |
Phần Fab của kháng thể anti-TNF-a đơn dòng người được pegylate hoá |
Bệnh Crohn |
Tiêm dưới da vùng trước dạ dày hoặc đùi 2 mũi riêng biệt, mỗi 2-4 tuần/với 3 liều đầu tiên và rồi mỗi 4 tuần/mũi. |
|
Etanercept |
Các đầu tiếp nhận protein-2 TNF-RII (p75) hoà màng được gắn với phần Fc của IgG1 người |
Viêm khớp dạng thấp Viêm khớp psoriasis Viêm đa khớp thiếu niên căn nguyên không rõ Psoriasis mảng mãn tính |
Tiêm dưới da 1-2 mũi/tuần |
|
Golimumab pegol |
Kháng thể đơn dòng toàn phần người anti-TNF-a |
Viêm khớp dạng thấp Viêm khớp psoriasis Viêm cột sống dính khớp |
Tiêm dưới da tháng/lần |
|
Infliximab |
Kháng thể đơn dòng (murine variable/human constant) nhân tạo kháng TNF-alpha |
Viêm khớp dạng thấp Bệnh Crohn Viêm loét đại tráng Viêm cột sống dính khớp Psoriasis |
Truyền TM 2-8 tuần/lần |
Nguồn: từ Furst DE, et al.
Có những khác biệt quan trọng trong số các thuốc ức chế TNF liên quan là bằng cách nào chúng điều hoà hoạt động của TNF. Infliximab và etanercept, là những thuốc đầu tiên ức chế TNF đã được phát triển và đã được nghiên cứu nhiều nhất trong tình hình hiện nay. Infliximab có một ái tính lớn hơn đối với TNF, gắn với TNF ổn định hơn, và có một thời gian gắn lâu hơn so với etanercept. Bán đời sinh học của infliximab xấp xỉ 10 ngày và tác dụng sinh học của nó tồn tại lên đến 2 tháng. Trái lại, hiệu quả của etanercept lên TNF tồn tại ngắn hơn; bán đời sinh học là 3 ngày và nó gắn với TNF theo một hình thức thuận nghịch với một thời gian “mở - tắt” nhanh, nhờ đó gần 50% thành phần gắn với TNF sẽ phân ly trong vòng 10 ngày.
Các dữ liệu từ các nghiên cứu gợi ý rằng infliximab và adalimumab điều hoà thuận đáp ứng IFN-g của lymphocyte với một qui mô lớn hơn etanercept, về mặt lý thuyết ngăn cản khả năng của vật chủ để chống hoặc làm sạch các tác nhân gây bệnh sống nội bào. Các nghiên cứu thêm mô hình tác dụng kháng TNF trên chuột gây nhiễm lao đã cho thấy rằng infliximab và adalimumab thâm nhiễm và tồn tại u hạt lao với một qui mô lớn hơn etanercept, gợi ý có khả năng rằng chúng có thể gây ra sự cắt đứt tương đối lớn hơn tín hiệu TNF với trong u hạt. Các nghiên cứu này cho thấy một sự hợp lý sinh học rằng là các kháng thể đơn dòng infliximab và adalimumab hình như thích hợp hơn etanercept để gây sự hoạt hoá nhiễm lao tiềm tàng (LTBI).
Trị liệu bằng chất ức chế TNF và các nhiễm trùng nặng: Một triển vọng dịch tễ học
Tính an toàn liên quan đến infliximab đã trở nên rõ ràng trong quá trình thử nghiệm ngẫu nhiên có đối chứng điều trị viêm khớp dạng thấp, khi tăng nguy cơ viêm phổi cũng như nhiều trường hợp lao đã được quan sát. Các thử nghiệm ngẫu nhiên có đối chứng tương tự đối với etanercept đã không thấy được nguy cơ tăng nhiễm trùng nhưng các nghiên cứu này không đủ lực để phát hiện một sự tăng lên quá nhỏ của các tác dụng gây nhiễm trùng ngoại ý. Một tỷ lệ cao mới mắc lao đã được báo cáo trong các thử nghiệm điều trị adalimumab đối với viêm khớp dạng thấp trước với liều thuốc giảm và hướng dẫn sàng lọc đối với bệnh lao trước ở các đối tượng nghiên cứu, và ít nhất một thử nghiệm ngẫu nhiên có đối chứng đã tìm thấy tăng nguy cơ nhiễm trùng nghiêm trọng khi adalimumab được kết hợp với methotrexate so với điều trị đơn thuần bằng adalimumab.
Mới đây hơn, các nghiên cứu quan sát với lượng bệnh nhân lớn đã đánh giá nguy cơ nhiễm trùng của các chất ức chế TNF. Ở châu Âu, nơi mà các dữ liệu chăm sóc y tế quốc gia làm dễ cho các nghiên cứu dịch tễ, các đăng ký đã được hình thành đối với các bệnh nhân mắc các bệnh viêm mãn tính được điều trị với các chất trị liệu sinh học. Tỷ lệ nhiễm trùng ở bệnh nhân viêm khớp dạng thấp đang được điều trị với các chất ức chế TNF đã được tính toán và so sánh với tỷ lệ nhiễm trùng được tìm thấy ở các bệnh nhân không được điều trị với chất ức chế TNF cũng như quần thể tổng quát. Hầu hết các nghiên cứu này, cũng như các nghiên cứu ở Mỹ đã dựa lên các dữ liệu quản lý, đã báo cáo các nguy cơ tương tự tăng lên đối với nhiễm trùng nghiêm trọng (Bảng 2).
Bảng 2. Nhiễm khuẩn nặng ở bệnh nhân viêm khớp dạng thấp được điều trị với chất ức chế TNF: Các nghiên cứu tiến cứu quan sát ở Âu châu và Bắc Mỹ.
|
Nước |
Nhóm dùng chất ức chế TNF (tỷ lệ mới mắc/100 BN - năm) |
Nhóm so sánh không thuốc (tỷ lệ mới mắc/100 BN - năm) |
RRa được điều chỉnh (95% CI) |
|
Hoa Kỳ |
2.9b |
1.4b |
4.2 (2.0-8.8)b 1.9 (1.3-2.8) |
|
Đức |
6.4 (ETN) 6.2 (INF) |
2.3 |
2.2 (0.94-5.4) 2.1 (0.8-5.5) |
|
Anh |
5.5 |
3.9 |
1.3 (0.9-1.8) 4.6 (1.8-11.9)c |
|
Thuỵ Điển |
5.4 |
Chưa xuất bản |
1.43 (1.2-1.7)d |
ETN = etanercept; INF = infliximab
a Tỷ lệ tương đối người không dùng thuốc sinh học được dùng đối chiếu
b Phân tích được hạn chế trong 6 tháng đầu sau khi bắt đầu dùng chất ức chế TNF
c Phân tích được hạn chế trong 90 ngày đầu sau khi bắt đầu điều trị bằng chất ức chế TNF
d Tỷ lệ được tính toán 1 năm sau khi bắt đầu điều trị và được điều chỉnh đối với độ nặng của viêm khớp dạng thấp và bệnh cùng mắc liên quan đến nhiễm khuẩn
Nghiên cứu dựa lên quần thể chính ở Hoa Kỳ được phân tích thông báo dữ liệu từ bệnh nhân viêm khớp dạng thấp ở khu vực Đông Nam Hoa Kỳ. Tỷ lệ nhiễm khuẩn nặng ở người dùng chất ức chế TNF đã tăng lên 2 lần so với người không dùng và là cao nhất (nguy cơ tương đối, 4,2) trong 6 tháng đầu sau khi bắt đầu điều trị chất ức chế TNF. Các nhà nghiên cứu Đức đã ghi nhận tư liệu tỷ lệ nhiễm khuẩn nghiêm trọng trong số bệnh nhân viêm khớp dạng thấp được tuển từ đầu và theo dõi trong quá trình điều trị bằng chất ức chế TNF sẽ là 6/100 bệnh nhân - năm, có hơn 2,5-lần cao hơn so bệnh nhân không dùng chất ức chế TNF. Các nhà nghiên cứu Anh quốc đã tìm thấy tỷ lệ tương tự ở nhóm bệnh nhân dùng thuốc đặc hiệu (chất ức chế TNF) (5,3/100 bệnh nhân – năm) và ghi nhận số liệu là 4-lần cao hơn viêm xương tuỷ ở bệnh nhân viêm khớp dạng thấp được điều trị chất ức chế TNF so với bệnh nhân cùng loại không dùng chất ức chế TNF. Lưu ý là khi phân tích lại các dữ liệu này, hạn chế lần quan sát với 3 tháng đầu sau khi dùng chất ức chế TNF, một nguy cơ cao hơn có ý nghĩa (tăng 4 lần) đối với tất cả các kiểu nhiễm khuẩn nghiêm trọng đã được tìm thấy, và nguy cơ tương tự với infliximab, adalimumab, và etanercept.
Dữ liệu quần thể tương đối vừa đủ sẵn có để đánh giá tính an toàn của các chất ức chế TNF ở bệnh nhân mắc bệnh ruột viêm (IBD). Các bệnh nhân trong 2 nghiên cứu tiến cứu tương lai ở Minnesota (N = 500) và Scotland (N = 220) đã báo cáo tỷ lệ cao nhiễm khuẩn nặng (chừng 11% đối với nghiên cứu Scottish), đặc biệt trong 90 ngày đầu sau khi bắt đầu dùng thuốc điều trị, mặc dầu cả hai nghiên cứu đã thiếu nhóm so sánh không dùng chất ức chế TNF qua đó để đánh giá các tỷ lệ này.
Trị liệu bằng chất ức chế TNF và các nhiễm trùng cơ hội: Một triển vọng dịch tễ học
Cho đến nay, bệnh lao là biến chứng nhiễm khuẩn thường được báo cáo nhất trong bối cảnh dùng chất ức chế TNF và là mối quan tâm có ý nghĩa của y tế công cộng. Vấn đề quan trọng của TNF đã cho với sự hình thành và tồn tại của u hạt, hầu hết các trường hợp lao được báo cáo trong bối cảnh này được nghĩ là các trường hợp của nhiễm bệnh lao tiềm tàng (LTBI) mà tiến triển thành bệnh hoạt động trong quá trình điều trị bằng chất ức chế TNF. Tuy nhiên, một số trong các trường hợp này, đại diện một cách thích hợp nhiễm lao mắc phải mới từ phơi nhiễm lao mới trong khi tiếp tục điều trị bằng chất ức chế TNF. Các tỷ lệ và nguy cơ đối với lao trong quá trình điều trị bằng chất ức chế TNF thay đổi trên thế giới, lệ thuộc vào nguy cơ ban đầu đối với lao trong quần thể tổng quát. Ở Hoa Kỳ, một vùng có tỷ lệ hiện mắc lao thấp, các nghiên cứu dựa vào quần thể được điều hành ngay sau khi được phê chuẩn infliximab được ước lượng hang năm tỷ lệ mắc lao 52,5/100.000 trong số bệnh nhân mắc viêm khớp dạng thấp được điều trị với infliximab so với 6,2/100.000 trong một nghiên cứu tiến cứu tương lai về viêm khớp dạng thấp không điều trị chất sinh học này, mặc dầu sự khác biệt không có ý nghĩa thống kê.
Ở Thuỵ Điển, báo cáo là bệnh lao tăng 4 lần ở bệnh nhân viêm khớp dạng thấp được điều trị thuốc kháng TNF so với bệnh nhân cùng bệnh không dùng thuốc này để điều trị. Trong số 15 bệnh nhân lao được tìm thấy trong nhóm dùng thuốc, 10 bệnh nhân được điều trị với infliximab và 5 được điều trị với etanercept. Tỷ lệ thô toàn bộ của lao ở nhóm bệnh nhân dùng thuốc ức chế TNF là 118/100.000, trên cơ sở của 5/100.000 ở các nhà nghiên cứu trên dân Thuỵ Điển đã quan sát tỷ lệ lao 10-20 lần cao hơn ở nhóm bệnh nhân viêm khớp dạng thấp được điều trị với chất thuốc ức chế TNF (hầu hết xảy ra ở bệnh nhân dùng infliximab) được so với bệnh nhân viêm khớp dạng thấp không được điều trị với thuốc đó. Tỷ lệ mới mắc của lao giảm rất đáng kể sau khi thực hiện việc sàng lọc mắc lao tiềm tàng và điều trị trước khi dùng thuốc ức chế TNF. Dữ liệu đăng ký ở Anh Quốc cũng đã báo cáo tỷ lệ lao trong bối cảnh này cũng trên cơ sở tỷ lệ lao trong quần thể. Có 10 trường hợp lao được phân lập với tỷ lệ mới mắc 50 - 150/100.000 dân - năm, lệ thuộc vào chất ức chế TNF đã được dùng. Tỷ lệ cao hơn (nhưng không có ý nghĩa thống kê) được quan sát ở bệnh nhân được điều trị với adalimumab hoặc infliximab.
Các nguy cơ nhiễm khuẩn cơ hội khác ít rõ ràng hơn nhiều. Ngiên cứu ở Anh Quốc đã được nêu trên đã ghi tư lịêu 19 trường hợp nhiễm khuẩn nội bào (kể cả 10 trường hợp lao đã nêu trên) đối với một tỷ lệ mới mắc 200/100.000 bệnh nhân – năm ở người dùng chất ức chế TNF trong nghiên cứu tiến cứu cohort viêm đa khớp dạng thấp của họ. Các nhiễm khuẩn nội bào khác đã quan sát gồm nhiễm salmonella (n = 3) và listeria (n = 3), cũng như mycobacteria không gây bệnh lao (NTM) (n = 3). Trong nhóm nghiên cứu của chúng tôi mới đây đã điều tra các nhà tư vấn bệnh nhiễm ở Hoa Kỳ qua mạng lưới bệnh nhiễm khuẩn mới trổi dậy. Các kết quả điều tra gợi ý rằng cả bệnh do mycobacterium không gây lao (hầu hết là do M. avium) và histoplasma thường xảy ra thích hợp hơn là lao trong bối cảnh này ở Hoa Kỳ. Ở Pháp, một nghiên cứu tiến cứu ở bệnh nhân viêm khớp dạng thấp tiếp theo sau 1 năm đã tìm thấy 10 ca legionella (6 bệnh nhân được điều trị với adalimumab, 2 bệnh nhân điều trị với etanercept, 2 bệnh nhân điều trị với infliximab), và được ước lượng rằng tỷ lệ mới mắc trong nghiên cứu tiến cứu tương lai này là 16-21 lần cao hơn trong quần thể tổng quát. Hơn nữa các nghiên cứu dựa vào quần thể tổng quát cần được đánh giá về nguy cơ đối với các nhiễm khuẩn này và đối với các nhiễm khuẩn cơ hội khác, vì chúng thay đổi một cách thích hợp bởi khu vực phù hợp với các yếu tố môi trường và các yếu tố quần thể.
Sàng lọc đối với bệnh lao
Theo một ước lượng, có 1/3 dân số thế giới đã từng phơi nhiễm với lao. Đa số là phát triển bệnh lao tiềm tàng mà duy trì dạng bệnh ngủ yên suốt đời, nhưng gần 10% tiến triển thành bệnh lao hoạt động trong quá trình sống của họ, với nguy cơ cao nhất là 2 năm đầu sau sơ nhiễm lao. Nguy cơ này tăng lên ở bệnh nhân có tình trạng suy giảm miễn dịch, gồm nhiễm HIV, đái đường, bệnh thận giai đoạn cuối, và các bệnh cần đến điều trị thuốc ức chế miễn dịch.
Các chất ức chế TNF phải dùng với sự thận trọng với bât cứ người nào có nguy cơ phơi nhiễm lao, và bệnh nhân phải được sàng lọc đối với bệnh lao tiềm tàng trước khi bắt đầu dùng các thuốc ức chế TNF, prednisolone, hoặc dùng thuốc ức chế miễn dịch lâu dài khác.Các yếu tố mà tăng xác xuất của sự phơi nhiễm lao trước, gồm những người: Sinh ra hoặc cư trú ở một nước nơi đó bệnh lao phổ biến; Ở tù; Người vô gia cư; Người nghiện ma tuý; Làm việc nơi điều trị bệnh lao; Tiền sử có một test sàng lọc lao dương tính (máu hoặc da); và người mà X quang phổi có thương tổn lao trước đó.
Việc hướng dẫn sàng lọc đối với bệnh lao tiềm tàng được nhiều hội y khoa chuyên nghiệp công bố. Các yêu cầu thay đổi phù hợp với các miền vùng khác nhau trên nền tảng sự phổ biến của bệnh lao cũng như việc dùng vaccine BCG, mà có thể trở ngaị cho việc giải thích test da Mantoux. Vì test Mantoux ở người được chủng do dùng kháng nguyên thiếu đặc hiệu đối với Mycobacterium tuberculosis, bệnh nhân có một tiền sử chủng ngừa BCG hoặc phơi nhiễm với vi khuẩn Mycobacterium không gây bệnh lao có thể gây ra kết quả test Mantoux dương tính giả. Người đọc kết quả test nên tham khảo hướng dẫn cụ thể tài liệu nhà nước hoặc vùng miền về sàng lọc đối với bệnh lao tiềm tàng khi họ áp dụng đối với các tình huống thực hành của họ và quần thể bệnh nhân.
Bước đầu tiên sàng lọc đối với bệnh lao tiềm tàng là hỏi toàn bộ tiền sử y khoa để xác định liệu rằng bệnh nhân có các yếu tố nguy cơ đối với việc phơi nhiễm trước với bệnh lao, chứng cớ nhiễm lao, hoặc đã điều trị thuốc kháng lao trước mà có thể không đầy đủ. Sau cùng, do các hướng dẫn đã được xuất bản không thống nhất, mặc dầu hầu hết các hướng dẫn yêu cầu dùng một hoặc cả hai test sàng lọc nhiễm lao tiềm tàng (LTBI): test tuberculine và / hoặc một test về máu mới hơn được gọi là thử nghiệm giải phóng IFN-g(IGRAs). Test thử nghiệm giải phóng IFN-g có một lợi ích hơn test tuberculine vì chúng dùng các protein từ RD-1 genome của M tuberculosis, một vùng mà không hiện diện trong dòng M. bovis được dùng để tạo ra vaccine BCG. Test IGRAs có độ đặc hiệu cao đối với M tuberculosis và không bị chủng ngừa BCG ảnh hưởng hoặc những dòng thích hợp nhất trên lâm sàng của Mycobacterium không gây ra bệnh lao. Hai test IGRAs có sẵn trên thị trường là: (1) the QuantiFERON®-TB Gold In-Tube (QFT-IT; Cellestis Limited; Victoria, Australia) và, (2) T-SPOT.TB ® (Oxford Immunotec; Oxfordshire, Anh Quốc). Các thử nghiệm này tối thiểu hoá con số bệnh nhân nói khác đi là những bệnh nhân được chẩn đoán nhiễm lao tiềm tàng không đúng do các kết quả test tuberculine dương tính giả. Thuỵ Sĩ (một nước với tỷ lệ hiện mắc lao thấp nhưng áp dụng chủng BCG cao) đã thừa nhận test IGRA như là một chiến lược sàng lọc bệnh nhân thích hợp về nhiễm lao tiềm tàng trong bối cảnh này.
Các yêu cầu này chưa ổn định mãi cho đến 1 – 2 năm vừa qua, có rất ít dữ liệu so sánh tính hữu ích của test IGRAs với test tuberculine trong việc sàng lọc này và các quần thể bị ức chế miễn dịch khác. Một nghiên cứu mới đây so sánh test tuberculine và QFT-IT ở bệnh nhân viêm khớp dạng thấp ở Peru, một vùng bệnh lao lưu hành cao, đã gợi ý rằng QFT-IT nhạy cảm hơn trong việc phát hiện nhiễm lao tiềm tàng. Mới đây, một nghiên cứu khác với bệnh nhân viêm khớp dạng thấp đã so sánh QFT-IT® với test tuberculine và, ngược lại, đã tìm thấy rằng một tỷ lệ phần trăm của bệnh nhân thấp hơn có các kết quả QFT-IT thấp hơn được so với các kết quả test tuberculine dương tính. Tuy nhiên, các dữ liệu phân ly này là thích hợp do tăng tính đặc hiệu của QFT-IT, khi nhiều bệnh nhân có kết quả test tuberculine dương tính/QFT-IT âm tính đã được phơi nhiễm với BCG. Các nghiên cứu khác so sánh TSPOT.TB ® và test tuberculine trong bối cảnh này đã cho thấy các kết quả khá tương tự và cũng gợi ý rằng TSPOT.TB ® nhạy cảm hơn test tuberculine ở bệnh nhân dùng corticosteroids.
Mặc dầu các test này dường như hứa hẹn, có các giới hạn về sự hữu ích của IGRAs trong bối cảnh này. Một tỷ lệ phần trăm nhỏ bệnh nhân được sàng lọc với IGRAs sẽ có những kết quả không được xác định mà không hữu dụng trên lâm sàng. Như với test tuberculine, IGRAs cũng có thể tạo ra các kết quả âm tính giả, đặc biệt ở bệnh nhân suy giảm miễn dịch gồm cả những bệnh nhân dùng thuốc kháng TNF.
Vì vậy, để cho các yêu cầu sàng lọc đạt được việc thực hiện tối ưu do khác biệt miền vùng địa lý; các thầy thuốc lâm sàng cần tuân thủ hướng dẫn của địa phương (ví dụ, các yêu cầu cụ thể của quốc gia) đối với việc sàng lọc các bệnh nhân này. Các yêu cầu cho việc sàng lọc, biện minh cho các khác biệt này được tóm tắt trong Hình 3. Nếu một test tuberculine được dùng, một điểm cắt 5 mm (Hình 4) sẽ được dùng để xác định (+), hãy nhớ rằng các kết quả âm tính có thể là âm tính giả, đặc biệt là các quần thể suy giảm miễn dịch. Dùng cả test tuberculine và IGRA sẽ tăng độ nhạy cảm có tính lý thuyết của việc sàng lọc, và nguy cơ cao đã cho đối với bệnh tiến triển ở các bệnh nhân dùng thuốc kháng TNF để điều trị, sai lầm phía độ nhạy có thể được xem xét.
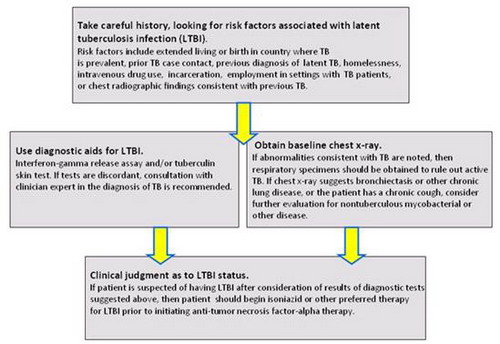
Hình 3. Sàng lọc các bệnh nhân đối với nhiễm lao tiềm tàng. Nguồn: Preventing and treating biologic-associated opportunistic infections. Nature Reviews Rheumatology. (in press)
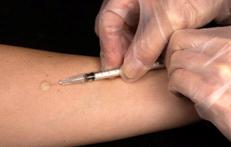
Hình 4. Kỹ thuật viên đang tiến hành một test Mantoux da (TST) tại mặt trong cẳng tay bệnh nhân, mà sẽ tạo ra một nốt phồng có đường kính 6 mm – 10 mm. Test Mantoux da được dùng để đánh giá người nhiễm lao tiềm tàng. Test dẽ được đọc trong vòng 48-72 giờ sau khi thử. Nguồn: CDC, public domain.
Ý kiến của tác giả rằng là chụp 1 phim X quang phổi ngay từ đầu đối với tất cả bệnh nhân, không liên qua đến các kết quả của test sàng lọc hoặc yếu tố nguy cơ đối với bệnh lao, và rằng là một phim X quang phổi (Hình 5) sẽ được dùng để sàng lọc bệnh lao hoạt động trong bất kỳ bệnh nhân nào bị nghi nhiễm lao tiềm tàng.
Sauk hi sàng lọc âm tính kế đến là bắt đầu dùng thuốc ức chế TNF, người ta không rõ có cần thiết lặp lại sàng lọc đối với bệnh nhân tiếp tục trị liệu bằng thuốc ức chế TNF. Các hướng dẫn hiện nay không yêu cầu kiểm tra lao hang loạt hoặc hàng năm đối với bất kỳ nhóm bệnh nhân suy giảm miễn dịch, với ngoại trừ các bệnh nhân nhiễm HIV họ có nguy cơ phơi nhiễm lao. Nếu sau khi bắt đầu điều trị thuốc ức chế TNF, một bệnh nhân có tiềm năng phơi nhiễm với bệnh lao, thì nên lặp lại sàng lọc lao.
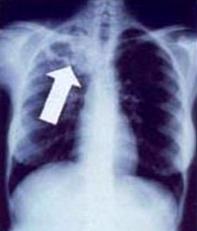
Hình 5. Trong bệnh lao hoạt động, sự thâm nhiễm, đông đặc, và / hoặc hang lao (xem mũi tên) thường được nhìn thấy ở đỉnh phổi. Nguồn: Wikipedia, the free encyclopedia.
Phòng nhiễm lao tiềm tàng
Điều trị nhiễm lao tiềm tàng nên bắt đầu trước khi bắt đầu điều trị bằng thuốc ức chế TNF ở bệnh nhân với kết quả sàng lọc gợi ý là nhiễm lao tiềm tàng và sau khi bệnh lao hoạt động đã được loại trừ. Nhiễm lao tiềm tàng phải được điều trị một quá trình 9 tháng với isoniazid, hoặc đối với bệnh nhân không dung nạp isoniazid, một quá trình 4 tháng với rifampin. Tải lượng vi khuẩn trong nhiễm lao tiềm tàng thấp, vì vậy, không cần hoàn thành tiến trình điều trị này trước khi bắt đầu điều trị thuốc ức chế TNF. Trong một nghiên cứu, một chiến lược để điều trị bệnh nhân nhiễm lao tiềm tàng với isoniazid ít nhất 1 tháng trước khi bắt đầu điều trị với infliximab có bằng chứng về tư liệu cho biết giảm được 85% trường hợp lao. Nhiễm độc gan là một mối quan tâm tiềm năng đối với isoniazid, đặc biệt đối với bệnh nhân lớn tuổi người đang được điều trị đồng thời với methotrexate. Một cách thích hợp, nên phải kiểm tra chức năng gan vào lúc bắt đầu và rồi phải làm hang tháng suốt quá trình điều trị với isoniazid ở bất cứ bệnh nhân nào tăng nồng độ transaminase huyết thanh, bệnh gan, hoặc dùng đồng thời với các thuốc có khả năng gây độc cho gan khác trong quá trình điều trị bằng isoniazid.
Trong quá trình theo dõi, người thầy thuốc lâm sàng nên cảnh giác về việc đánh giá về các triệu chứng kinh điển (ví dụ, sốt, ra mồ hôi đêm, biếng ăn, sút cân) hoặc các triệu chứng về phổi gợi ý của bệnh nhân lao khi tiến hành điều trị bằng thuốc ức chế TNF. Một tỷ lệ cao (= 50%) bệnh nhân hiện diện thể lao ngoài phổi hoặc thể lao lan toả, vì vậy mà X quang phổi sẽ là bình thường trong nhiều trường hợp của bệnh nhân loại này. Các chất ức chế TNF và các điều trị các chất sinh học khác sẽ phải được ngừng lại ở các bệnh nhân được điều trị với lao trong bối cảnh này và chế độ chuẩn 4 thuốc kháng lao isoniazid, pyrazinamide, rifampin, và ethambutol phải được bắt đầu. Mặc dầu ít gặp, hội chứng viêm do tái tạo miễn dịch (IRIS) có thể xảy ra sau khi bắt đầu điều trị đối với bệnh lao. Sẽ là an toàn để bắt đầu lại việc dùng thuốc ức chế TNF sau khi hoàn tất chế độ điều trị lao, nhưng không rõ là liệu rằng điều trị bằng thuốc ức chế TNF có thể được tái hình thành một cách an toàn trong quá trình điều trị lao hay không. Điều này sẽ không được cân nhắc cho đến lúc bệnh nhân có ít nhất sự cải thiện lâm sàng có ý nghĩa và sự tuân thủ chế độ thuốc điều trị bệnh lao.
Các nhiễm trùng nặng khác ở bệnh nhân điều trị bằng chất ức chế TNF
Mycobacteria không gây lao
Các bệnh do mycobacterium không gây bệnh lao ngoài phổi và ở phổi từng được báo cáo ở bệnh nhân được dùng các thuốc sinh học để điều trị, và trong những miền vùng mà sự phổ biến của bệnh lao thấp, thì nhiễm mycobacterium không gây lao phổ biến hơn là bệnh lao. Người ta cũng biết các mycobacterium không gây bệnh lao là những mycobacteria môi trường, mycobacteria không điển hình, hoặc là các mycobacteria khác hơn là mycobacteria tuberculosis, hiện diện trong môi trường và trong nước. M avium chịu trách nhiệm một tỷ lệ rất lớn của bệnh không phải lao do mycobacterium gây ra trong số loài mycobacterium không gây ra bệnh lao khác. Bệnh nhân mắc bệnh phổi trước ở bệnh nhân viêm khớp dạng thấp, bệnh phổi tắc nghẽn mãn tính, dãn phế quản, và các bệnh phổi khác có nguy cơ tăng mắc bệnh phổi do các mycobacterium không gây bệnh lao gây ra. Ở bệnh nhân dùng các thuốc ức chế TNF, nhiễm khuẩn ở phổi và nhiễm lan toả do M avium, M marinum, M kansasii, M abscessus, hoặc các Mycobacterium sp. khác đã được báo cáo (một số được kết hợp với mắc bệnh nặng và tử vong), nhưng không rõ liệu rằng các nhiễm khuẩn này có thể phòng ngừa được hay không.
Lợi ích của việc sàng lọc đối với các mycobacterium không gây bệnh lao trước khi dùng thuốc kháng TNF để điều trị là hoàn toàn mang tính lý thuyết. Bệnh nhân với phim phổi bất thường hoặc ho mãn tính không rõ nguyên nhân phải được đánh giá thêm nữa bằng chụp phổi cắt lớp và nuôi cấy mẫu nghiệm hô hấp trước khi bắt đầu điều trị thuốc ức chế TNF. Sự an toàn của việc dùng đồng thời thuốc ức chế TNF chưa được biết ở bệnh nhân mắc bệnh do mycobacterium không gây lao hoạt động (điều trị hoặc không điều trị).
Các loại nấm lưu hành
Histoplasma capsulatum.
H capsulatum (Hình 6) là một loài nấm lưỡng hình phân bố khắp thế giới. Các miền nhiệt đới trên thế giới và Tennessee, Ohio, và đồng bằng sông Mississippi Hoa Kỳ là vùng dịch lưu hành cao. Histoplasmosis được báo cáo phổ biến hơn các loại nhiễm nấm khác ở bệnh nhân dùng thuốc ức chế TNF ở Hoa Kỳ. Sau khi hít (tương tự lao), Histoplasma có thể gây bệnh phổi nguyên phát hoặc lan toả tới các hệ thống cơ quan khác. Ngoài ra, Histoplasmacó thể duy trì nhiễm tiềm tàng nhiều năm hoặc về sau tiến triển thành nhiễm nấm hoạt động suốt quá trình bị ức chế miễn dịch. Về mặt lý thuyết, bệnh nhân có thể được sàng lọc đối với nấm Histoplasma trước khi bắt đầu điều trị thuốc kháng TNF. Một kết quả test huyết thanh dương tính sẽ gợi ý là nhiễm nấm trước đây; tuy nhiên, không rõ các test này hữu ích như thế nào và liệu rằng những kết quả dương tính chỉ định một nhu cầu dự phòng và tránh điều trị bằng thuốc ức chế TNF. Nhiễm nấm histoplasma là một bệnh phổi và lan tỏa theo đường máu; bệnh có thể biểu hiện không triệu chứng, viêm phổi cấp hoặc mãn tính hoặc lan toả đến các cơ quan ở xa. Chẩn đoán được tiến hành bằng cách dùng hình ảnh X quang phổi, chẩn đoán huyết thanh, cấy nấm, nhuộm đàm hoặc mô, test kháng nguyên nước tiểu (UAT).
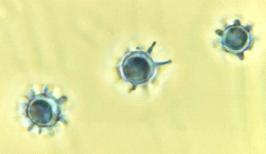
Hình 6. Dưới độ phóng đại 1125 x, hình ảnh này biểu thị 3 hình ảnh nấm Histoplasma capsulatum macroconidia, khác với microconidia bởi sự hiện diện các chồi nhú (projection) bắt nguồn từ bề mặt của chúng. H capsulatum là nguyên nhân gây histoplasmosis. Nguồn: CDC, public domain
Những cân nhắc sàng lọc và phòng ngừa.
Không yêu cầu kiểm định huyết thanh thường qui về nhiễm histoplasma ở bệnh nhân nhiễm HIV, mặc dầu dự phòng với itraconazole (200 mg/ngày) có lợi đối với các bệnh nhân suy giảm miễn dịch nặng (lượng tế bào T CD4+ < 150 tb/µL) người sống trong vùng histoplasma lưu hành. Tuy nhiên, việc phòng ngừa như vậy đã không cho thấy giảm tỷ lệ tử vong trong bối cảnh này. Tương tự, ở các tình trạng suy giảm miễn dịch khác, như ghép cvơ quan, dự phòng bằng itraconazole ở vùng dịch lưu hành nặng đã không đem lại lợi ích nào. Một số lớn bệnh nhân đã được điều trị chất ức chế TNF người sống trong vùng dịch histoplasma lưu hành và tỷ lệ mới mắc tương đối thấp ở các bệnh nhân này, thì nhu cầu và lợi ích của việc sàng lọc nhiễm histoplasma hoặc dự phòng cho cộng đồng đối chưa được rõ lắm.
Trị liệu bằng chất ức chế TNF phải được ngừng và điều trị theo kinh nghiệm amphotericin bằng được tĩnh mạch phải được cân nhắc đối với các bệnh nhân phát triển các triệu chứng chắc chắn của histoplasma phổ hoặc lan toả trong quá trình dùng thuốc ức chế TNF.Histoplasma UAT có độ nhạy cao để chẩn đoán bệnh lan toả, mặc dầu ít nhạy với bệnh nhân mắc bệnh ở phổi.
Bệnh nhân mắc histoplasmosis được dùng thuốc kháng nấm lâu dài (khả năng là suốt đời đối với mắc nấm lan toả). Trong trường hợp điều trị histoplasmosis đã được hoàn tất và người ta nghĩ bệnh đã được loại bỏ hjoàn toàn, người ta không rõ liệu thuốc ức chế TNF có thể an toàn để bắt đầu dùng hay không. Bệnh nhân đã thành công trong điều trị hoàn tất đối với histoplasmosis và ở những người được giả định là điều trị thuốc ức chế TNF được xem là cần thiết thì sẽ nên sàng lọc UAT trước khi bắt đầu điều trị và rồi kiểm tra từng đợt (thậm chí nhiều tháng) trong quá trình điều trị. Vì với các tình trạng suy giảm miễn dịch khác, một kết quả tăng nồng độ UAT sẽ khởi sự ngừng thuốc ức chế TNF và một tìm kiếm chẩn đoán histoplasmosis đang hoạt động cần được thực hiện.
Coccidioides.
Bệnh nấm Coccidioides (coccidioidomycosis) do C immitis hoặc C posadasii gây ra, là bệnh nấm lưu hành hai hình thái ở vùng Tây Nam Hoa Kỳ và miền Trung và miền Nam châu Mỹ. Người ta nghĩ phơi nhiễm với Coccidioides phổ biến ở khu vực này, có đến 29% viêm phổi trong cộng đồng ở khu vực này do coccidioidomycosis. Tác nhân gây bệnh phổi này, do hít vào hô hấp và có thể gây bệnh hoạt động cấp tính, hoặc có thể tồn tại tiềm tàng và về sau tiến triển thành bệnh hoạt động, đặc biệt trong quá trình suy giảm miễn dịch.
Nhiễm nấm coccidioides thường xảy ra như là một nhiễm trùng hô hấp cấp lành tính không triệu chứng hoặc tự giới hạn. Bệnh lan toả gặp phổ biến thế hệ người Á châu và Phi châu và thường liên quan đến da, xương, hệ bạch huyết hoặc hệ thần kinh trung ương. Chẩn đoán dựa lên các đặc điểm lâm sàng, X quang, dịch tễ học và được xác định bằng nuôi cấy và hoặc test huyết thanh.
Lợi ích sàng lọc bằng chứng huyết thanh nhiễm coccidioidomycosis trước khi dùng thuốc ức chế TNF mang tính lý thuyết, khi chỉ một số nhỏ trường hợp được điều trị thuốc ức chế TNF kết hợp với bệnh đã được báo cáo và hầu hết trường hợp là nhiễm cấp so với tái phản ứng. Ngoài ra, cá nhân nhiễm HIV sống trong vùng bệnh lưu hành thì không sàng lọc thường qui đối với coccidioidomycosis, và phòng bằng itraconazole đối với hầu hết bệnh nhân nhiễm HIV đã không cho thấy là hiệu quả. Ngừng thuốc ức chế TNF nếu bệnh nhân được chẩn đoán mắc coccidioidomycosis.
Quản lý coccidioidomycosis tuỳ vào vị trí và mức lan rộng của nhiễm nấm nhưng thường liên quan đến điều trị với fluconazole hoặc itraconazole. Amphotericin B thường được dùng vào thời điểm bệnh phát triển sớm và đôi khi điều trị nội tuỷ sống kéo dài đối với bệnh biểu thị ở hệ thần kinh trung ương. Bệnh nhân mắc coccidioidomycosis lan toả thường đòi hỏi điều trị suốt đời. Không giống với điều trị thuốc ức chế TNF liên kết với các trường hợp bệnh lao, chưa có báo cáo nào được thông báo liên quan đến tính an toàn và phải dùng lại thuốc ức chế TNF sau khi điều trị coccidioidomycosis thành công. Người ta cho rằng nguy cơ cao hơn đối với sự tái phản ứng của bệnh, dùng lại thuốc ức chế TNF có lẽ là lời khuyên cho bệnh nhân, đặc biệt đối với bệnh nhân có nhiễm coccidiomycosis lan toả.
Blastomyces dermatitidis.
B dermatitidis là một loài nấm lưỡng hình (dimorphic fungus) mà lưu hành ở Đông Nam và Trung Nam Hoa Kỳ, dọc theo song Mississippi và Ohio. Nhiễm nấm này ở phổi do hít phải bào tử nấm B dermatitidis; đôi khi nấm lan toả theo đường máu, gây ra bệnh ngoài phổi. Bệnh cảnh lâm sàng có thể hiện diện như các triệu chứng của cúm và viêm phổi, và nhiễm nấm phổi mãn tính hoặc là bệnh lan toả của da, xương, và đường tiết niệu có thể xảy ra. Liên quan đến hệ thần kinh trung ương thường ít gặp. Chẩn đoán được thực hiện dựa lên cơ sở đánh giá lâm sàng và / hoặc các dữ liệu X quang phổi, và được xác định bằng xét nghiệm nấm. Dùng thuốc ức chế TNF đã kết hợp với nhiễm nấm Blastomyces từng được báo cáo. Các yêu cầu đối với bệnh nhân điều trị thuốc ức chế miễn dịch bị nhiễm Blastomyces là tương tự với các bệnh nhân nhiễm histoplasma. Bệnh biểu hiện nhẹ được điều trị với itraconazole; bệnh nặng điều trị với amphotericin B.
Các tác nhân nội bào gây nhiễm trùng thực phẩm
Nhiễm Listeria và Salmonella.
Người ta cho rằng tín hiệu TNF sẽ là quan trọng đối với sức đề kháng vật chủ chống lạiListeria và Salmonella, và nhiễm listeria và salmonella đã từng được báo cáo trong quá trình điều trị bệnh nhân bằng thuốc ức chế TNF. L monocytogenes xâm nhập đường tiêu hoá người do nhiễm trong thịt và các sản phẩm sữa, gồm cả thịt tái hoặc thịt nấu chưa chín, thức ăn chế biến sẵn (delicatessen) hoặc thịt xông khói, sữa chưa xử lý qua quy trình Pasteur. Tránh dùng các sản phẩm này được yêu cầu đối với thai phụ, người tăng nguy cơ nhiễm listeria và cân nhắc về các yêu cầu tương tự sẽ được áp dụng đối với các bệnh nhân đã được dùng các thuốc ức chế TNF. Salmonella species có thể lây truyền qua con đường tương tự, gồm cả thực phẩm thô bị nhiễm, thực phẩm chưa được nấu kỹ, như thịt tươi và bơ làm từ sữa thô. Salmonella species cũng có thể lây truyền qua các loài bò sát mà chúng được bán để làm vật con vật cưng, chúng thường mang Salmonella. Người ta khuyên bệnh nhân nên phải rữa, nấu chin thức ăn, và nói chung thực hành vệ sinh đôi tay.
Virus viêm gan B và C
Thuốc thành phẩm mang nhãn hiệu về các chất ức chế TNF có chỉ dẫn cảnh báo rằng thuốc có thể làm tái hoạt động hoặc làm tồi tệ thêm về tình trạng nhiễm virus viêm gan B. Trước khi dùng thuốc ức chế TNF để điều trị, bệnh nhân phải được sàng lọc về nhiễm virus viêm gan B, và nói chung nên tránh dùng thuốc ức chế TNF ở bệnh nhân nhiễm trùng. Trái lại, người ta nghĩ rằng điều trị thuốc ức chế TNF có thể được dùng an toàn, mặc dầu với sự cảnh báo và chú ý cẩn thận với các enzyme về gan, ở bệnh nhân nhiễm virus viêm gan C mãn tính.
Kết luận
Thầy thuốc lâm sàng phải luôn cảnh giác về các nhiễm trùng cơ hội ở bệnh nhân đang dùng thuốc kháng TNF trong chế độ điều trị. Mặc dầu, nguy cơ các nhiễm trùng này nói chung là thấp và là các lợi ích lâm sàng của các điều trị này nói chung là cao, việc sàng lọc (ví dụ, bệnh lao) và giáo dục bệnh nhân (ví du, bệnh nhân nhiễm listeria) có thể giảm được nguy cơ đối với một số trong các biến chứng này. Bệnh nhân người phát triển một nhiễm trùng phải được đánh giá về việc điều trị kháng sinh thích hợp, và trường hợp bị nhiễm trùng nặng, thì điều tốt nhất là nên ngừng thuốc kháng TNF.
Các nhiễm khuẩn nghiêm nặng cũng dễ gặp hơn ở bệnh nhân điều trị ức chế TNF, và thầy thuốc lâm sàng phải chủng ngừa cho bệnh nhân họ để phòng ngừa nhiễm phế cầu và cúm phù hợp với các yêu cầu thực hành nghề nghiệp. Cần nghiên cứu thêm để hiểu rõ tốt hơn bằng cách nào để phòng ngừa các bệnh này và các bệnh nhiễm trùng nặng khác và tỷ lệ mắc bệnh liên quan đến chúng để bệnh nhân có thể hình dung một cách đầy đủ về các lợi ích lâm sàng của chất ức chế TNF và các dạng thuốc khác của cách điều trị sinh học này.
Các từ dùng trong bài
- Các thử nghiệm ngẫu nhiên có đối chứng (randomized controlled trails), viết tắt RCT, một nghiên cứu, mà các đối tượng nghiên cứu được chọn ngẫu nhiên và trong 2 nhóm, trong đó có một nhóm chứng và một nhóm can thiệp.
- Đầu tiếp nhận (receptor): còn gọi là tiếp thụ quan (hơi mang âm hưởng chữ Hán – Nôm), là bộ phận nằm ở bề mặt của tế bào đích để tiếp nhận dấu nối kết (ligand) đặc hiệu tương ứng ở mặt vi sinh vật.
- Đầu tiếp nhận toll-like (Toll-like receptors: TLR): Một họ của các đầu tiếp nhận nhận biết mô hình ở các động vật có vú chúng có thể phân biệt trong số các lớp hoá chất khác nhau của các sản phẩm vi sinh vật, gồm các thành phần của thành vi khuẩn; các đầu tiếp nhận toll-like này có thể khởi động các đáp ứng miễn dịch tế bào nguyên thuỷ đặc hiệu tác nhân gây bệnh.
- Gene phối hợp (chimeric gene): Một gene nhân tạo được hình thành nhờ kết hợp các phần tử của gene không liên quan hoặc các phân đoạn DNA khác, gene phối hợp chính nó có thể bị biến đổi.
- Hội chứng viêm do tái tạo miễn dịch (immune reconstitution inflammatory syndrome: IRIS), hội chứng xuất hiện sau khi điều trị bằng thuốc kháng lao ở một bệnh nhân mắc lao, giống như hội chứng viêm do tái tạo miễn dịch trong nhiễm HIV sau điều trị thuốc kháng virus hiệu lực cao.
- Tế bào diệt T CD-28 (Lymphocyte T CD-28 null): thuộc nhóm các tế bào diệt chiếm 2-13% tổng các tế bào lymphô của cơ thể có chức năng diệt các tế bào nhiễm virus và tế bào u
- Test kháng nguyên trong nước tiểu (urine antigen testing: UAT): test dùng để phát hiện kháng nguyên vi sinh vật có mặt trong nước tiểu nhờ việc dùng kháng thể đặc hiệu
- Trao tặng Kỷ niệm chương vì sự nghiệp khoa học công nghệ - 18/05/2020 15:41
- Trường Đại học Y Dược Huế đạt giải thưởng VIFOTEC - Giải thưởng sáng tạo khoa học công nghệ Việt Nam 2018 - 15/05/2019 11:32
- Lễ tôn vinh trí thức khoa học và công nghệ tiêu biểu 2019 - 23/05/2019 08:03
- Giải thưởng sáng tạo Khoa học Công nghệ tỉnh T-T-Huế lần thứ IX năm 2018 - 19/11/2018 14:05
- Lễ trao giải thưởng Sinh viên nghiên cứu khoa học và Khoa học công nghệ dành cho giảng viên trẻ năm 2018 - 27/10/2018 08:02
- Protein HBx điều hoà những con đường tăng sinh của tế bào gan để kích thích sự nhân lên của virus - 28/01/2015 10:20
- Hạ đường máu kết hợp với dùng Levofloxacin - 28/01/2015 10:19
- Coxsackievirus và bệnh tay chân miệng - 28/01/2015 10:19
- Streptococcus Suis (liên cầu lợn) – một tác nhân gây bệnh nguy hiểm mới - 28/01/2015 10:17
- Biến chứng cúm A/H5N1 khả năng gây bệnh và biện pháp phòng chống - 28/01/2015 10:16









 Chào mừng kỷ niệm
Chào mừng kỷ niệm













